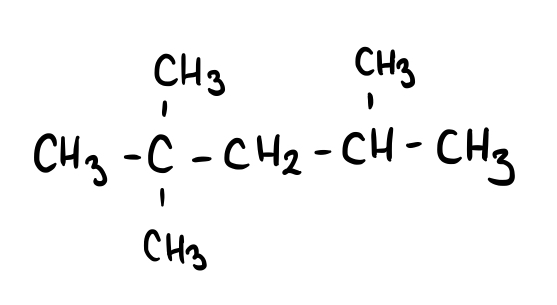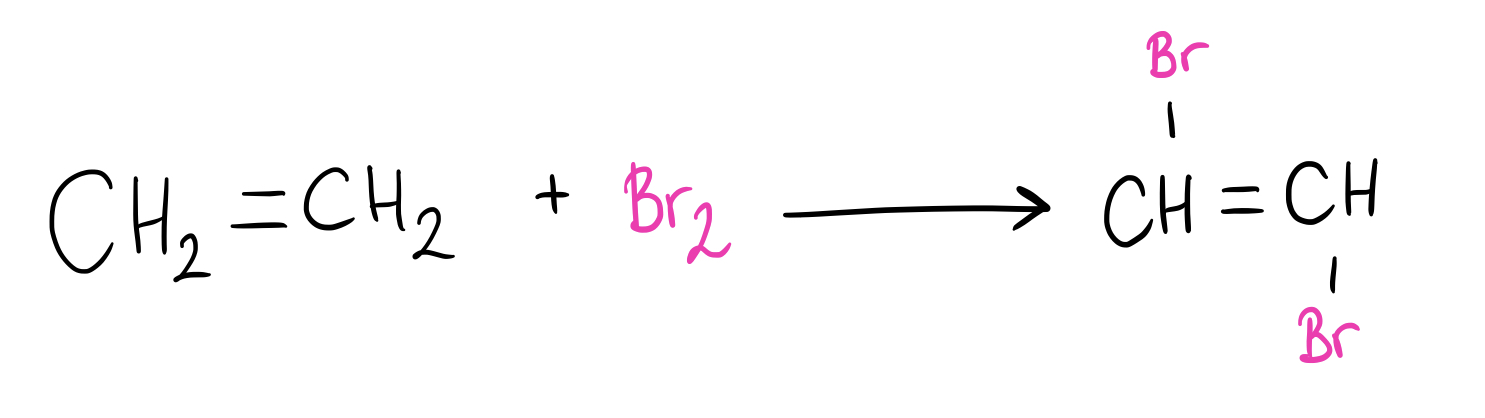Veamos, entonces, qué son los halógenos y cuáles son las reacciones que pueden llevar a cabo.
- Este artículo trata sobre las reacciones de los compuestos halogenados.
- Para comenzar, veremos qué es un halógeno y qué elementos químicos son halógenos.
- También estudiaremos las características de los halógenos.
- Para terminar, veremos la reacción más importante de los halógenos: la halogenación.
¿Qué es un halógeno?
Antes de empezar a ver cuáles son las principales reacciones que pueden llevar a cabo los compuestos halogenados, tenemos que ver una definición de los halógenos, pues deberíamos saber qué son exactamente, antes de empezar a entrar en su mundo.
Los halógenos son los elementos químicos que se encuentran en el grupo VII de la tabla periódica. Entre sus principales características tenemos que son elementos muy reactivos, muy electronegativos y que, usualmente, forman sales cuando se unen con otros elementos.
Los halógenos en la tabla periódica: los elementos halógenos
Ahora que ya hemos visto qué son los halógenos, exploremos cuáles son los elementos químicos que denominamos halógenos. Ya hemos visto que son los elementos que se encuentran en el grupo VII de la tabla periódica; pero, ¿cuáles son en concreto? Bien, pues son el flúor (F), el cloro (Cl), el bromo (Br), el yodo (I) y el astato (At).
Flúor (F)
El flúor (F) es el primero de los halógenos. Su fórmula molecular es F2, ya que es una molécula diatómica, y su número atómico es 9, lo que quiere decir que tiene 9 protones; además, es el elemento más electronegativo de todos los elementos existentes. Esto lo convierte, también, en un elemento con gran capacidad reactiva. Es el más pequeño de todos los halógenos y, a temperatura ambiente, se encuentra en forma gaseosa.
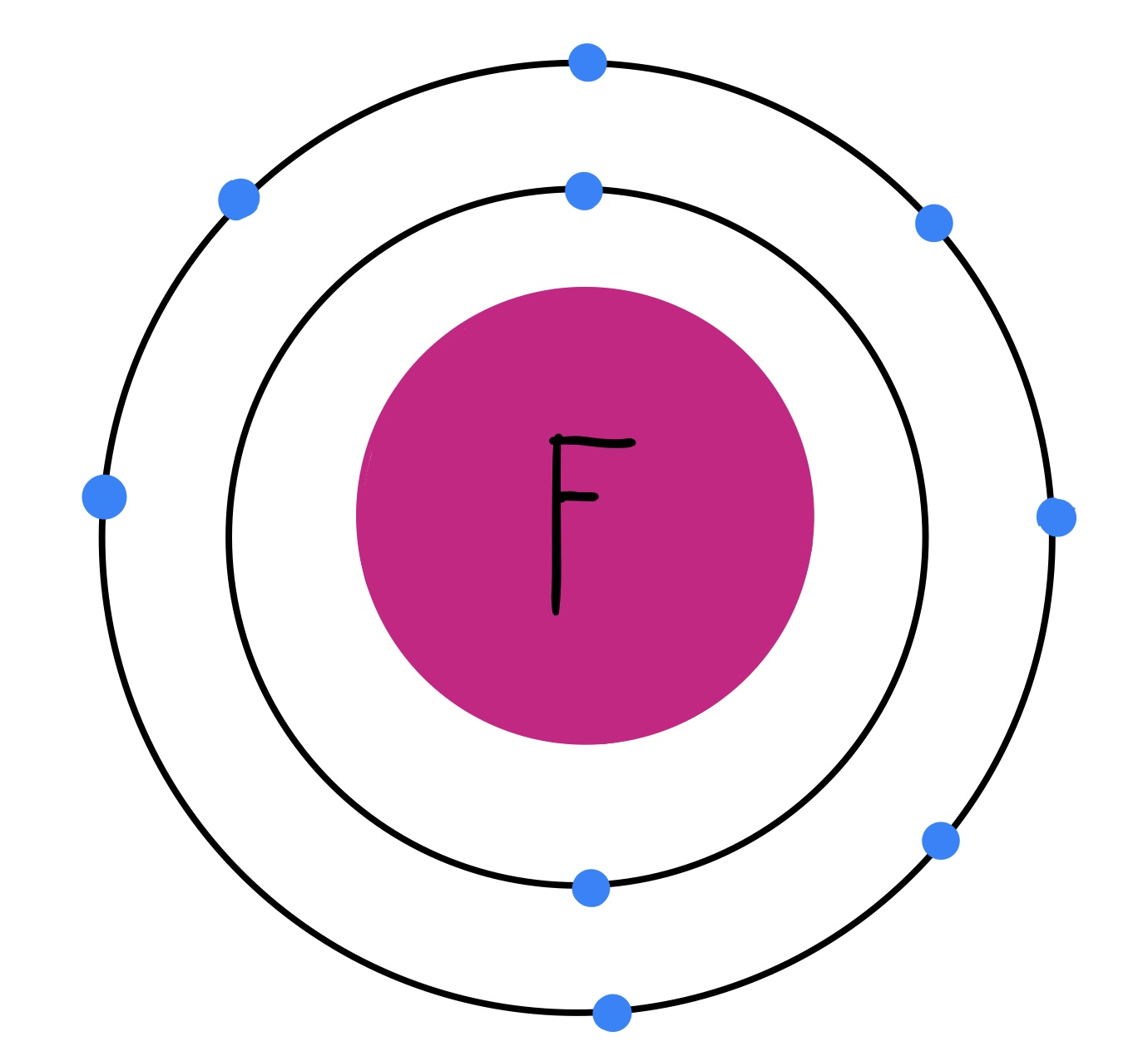
Fig. 2: Modelo atómico del flúor. Se pueden observar los 9 electrones distribuidos en dos capas. Tiene 7 electrones de valencia.
Cloro (Cl)
El cloro (Cl) es el segundo de los elementos químicos halógenos. Su número atómico es 17 y, al igual que el flúor, también forma moléculas diatómicas (Cl2, que es lo que denominamos cloro molecular). Es un elemento bastante electronegativo y reactivo; a temperatura ambiente, es un gas.
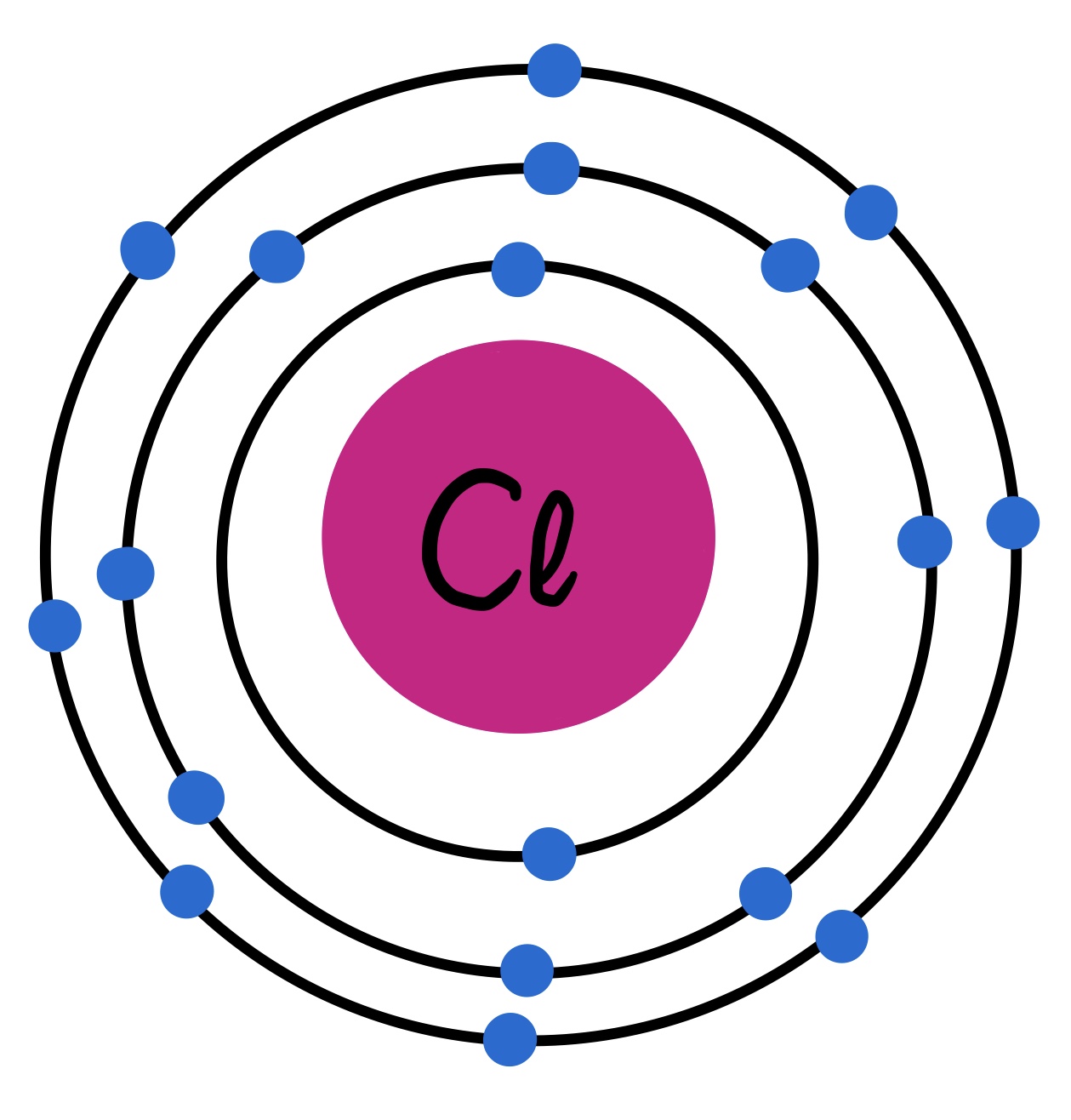
Fig. 3: Modelo atómico del cloro. Se pueden observar los 17 electrones distribuidos en 3 capas. Tiene 7 electrones de valencia.
Bromo (Br)
El bromo (Br) es el tercer halógeno de la tabla periódica, su número atómico es 35. Es un líquido a temperatura ambiente; el único elemento de la tabla periódica, junto con el mercurio (Hg), que es líquido en condiciones normales. Se encuentra como molécula diatómica, es decir, Br2. Al igual que el flúor y el cloro, es muy electronegativo y reactivo.
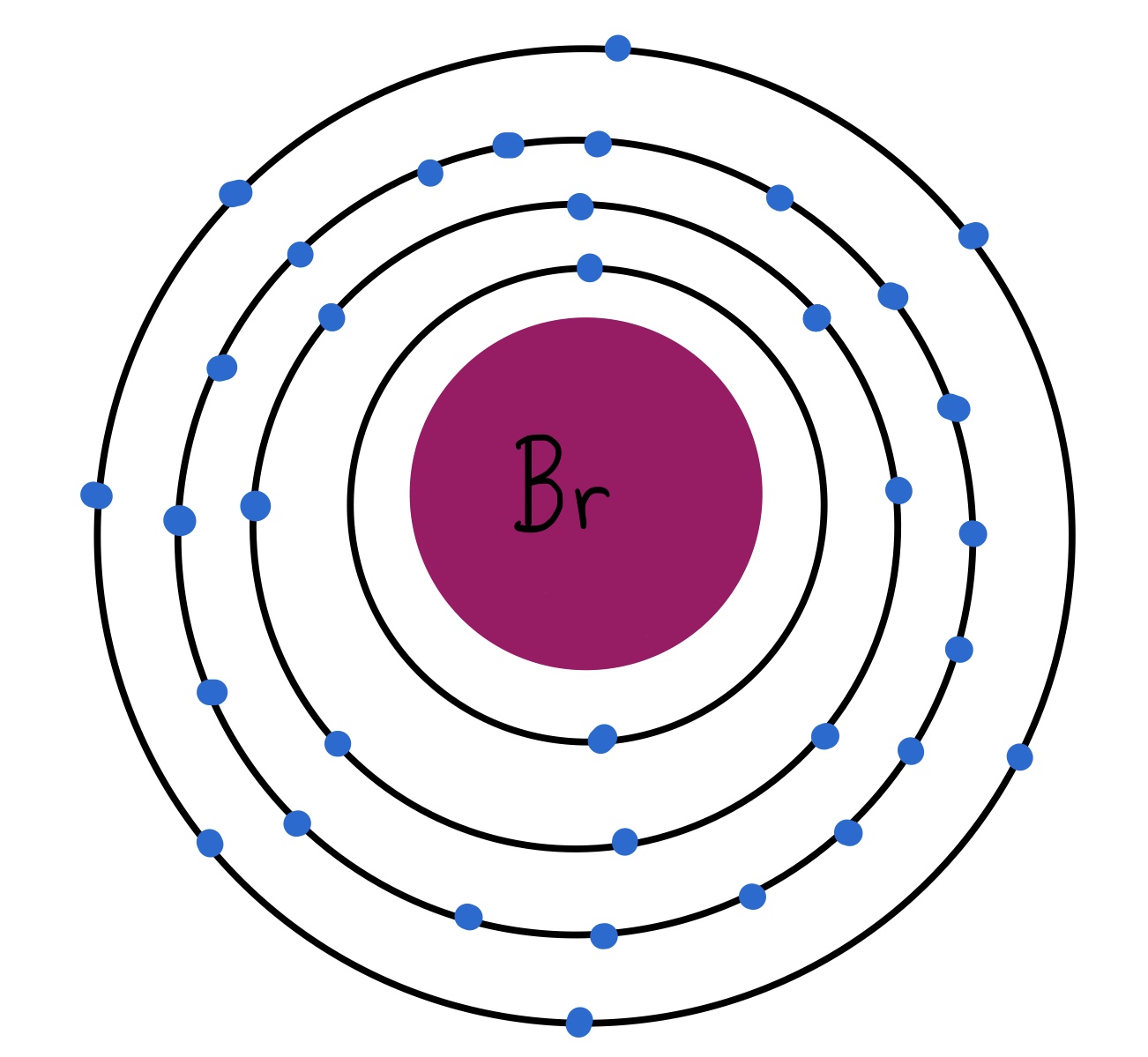
Fig. 4: Modelo atómico del bromo. Tiene 35 electrones distribuidos en 4 capas. Tiene 7 electrones de valencia.
Yodo (I)
El yodo (I) es un elemento químico que se encuentra en estado sólido a temperatura ambiente. Es el cuarto halógeno de la tabla periódica y su número atómico es 53. También se encuentra en la naturaleza como molécula diatómica; es decir, como I2. Es un elemento bastante reactivo.
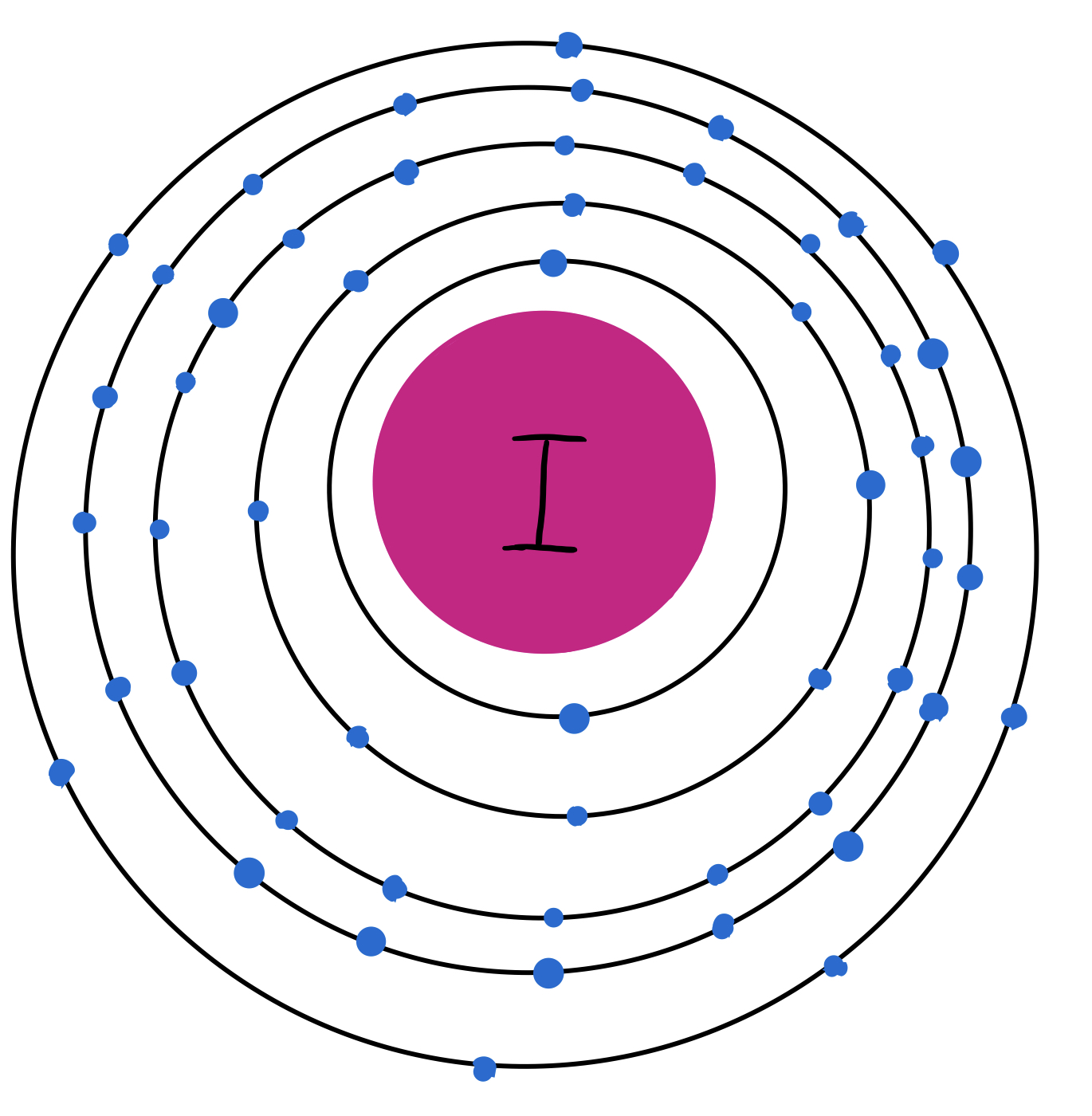
Fig. 5: Modelo atómico del yodo. Tiene los 53 electrones distribuidos en 5 capas y tiene 7 electrones de valencia.
Astato (At)
El astato (At) es el quinto y último halógeno de la tabla periódica, su número atómico es 85; por lo tanto, es el halógeno más grande de todos. A temperatura ambiente es sólido y se encuentra como molécula diatómica (At2).
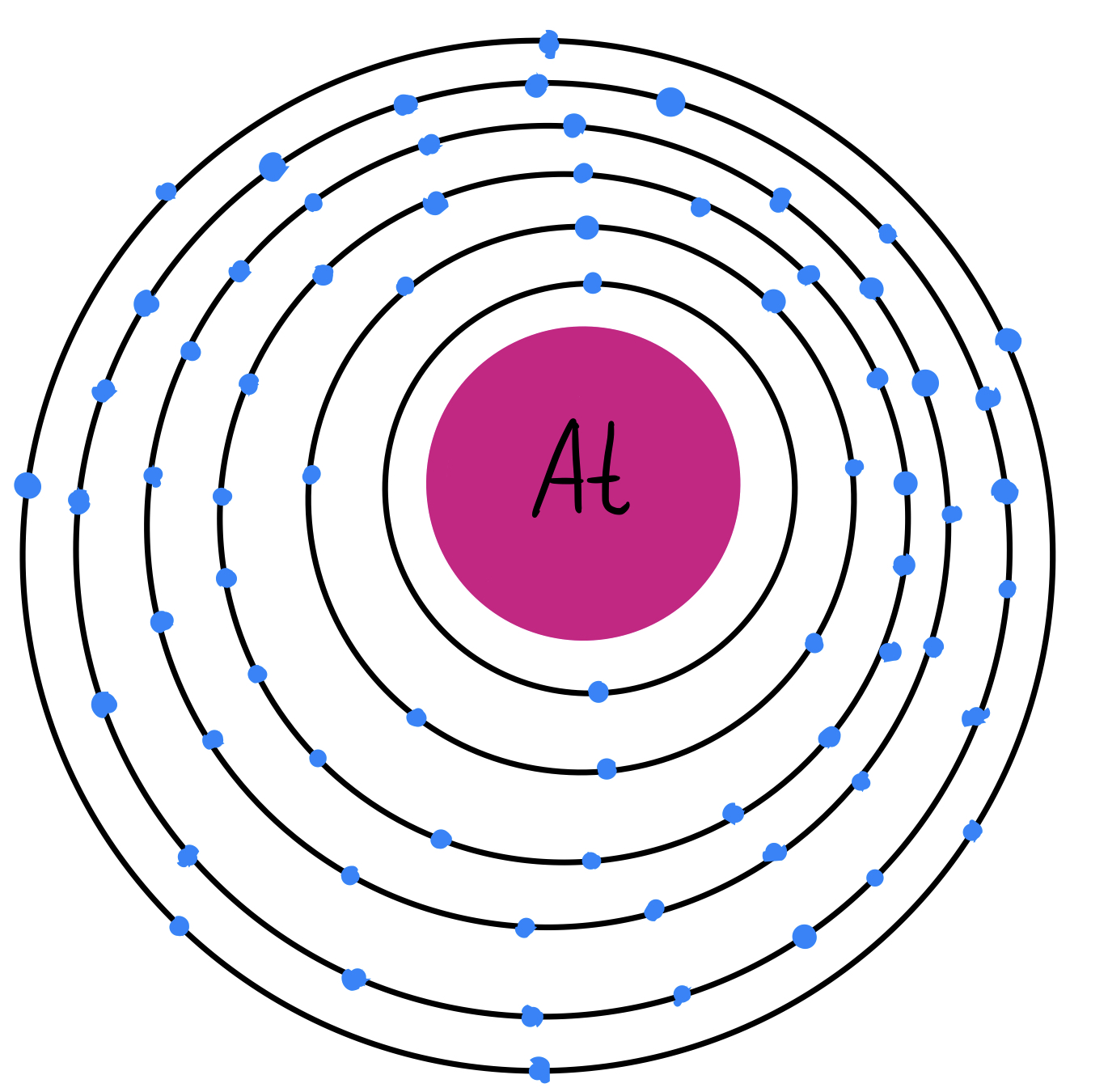
Fig. 6: Modelo atómico del astato. Se pueden observar los 85 electrones distribuidos en 6 capas. Tiene 7 electrones de valencia.
Características de los halógenos
Ahora sí, detengámonos en las características generales de los halógenos:
- Son elementosdiatómicos, ya que solamente les falta un electrón para llenar su capa de valencia (regla del octeto). Por esto, cada átomo se junta con otro de su misma especie, para ser más estables.
- Son muy reactivos.
- Son muy electronegativos.
- Son elementos químicos bastante peligrosos para el ser humano.
- Se pueden encontrar en estado gaseoso (cloro y flúor), líquido (bromo) o sólido (yodo y astato).
Halogenación: formación de compuestos halogenados
La halogenación es una de las principales reacciones que podemos llevar a cabo con los halógenos. Es un proceso por el cual se introduce un átomo de un halógeno en otra molécula.
La halogenación es un tipo de reacción química en la que a una molécula se le añaden uno o varios átomos de halógeno; es decir, de flúor, cloro, bromo, yodo o astato.
La halogenación puede ser de varios tipos. Los principales son los siguientes:
Halogenación de alcanos
Veamos algunos ejemplos para entender mejor cómo se produce:
¿Cómo sería la reacción del metano con cloro molecular?
¿Cuál es el producto o producto resultante o resultantes?
Solución:
Veamos primero cuál es la fórmula de cada uno de los reactivos:
- Metano: CH4.
- Cloro molecular: Cl2.
Por lo tanto, la reacción será la siguiente:
$$CH_{4}+Cl_{2}\rightarrow CH_{3}Cl + HCl$$
Los dos productos que se obtienen son el clorometano (CH3Cl, compuesto halogenado) y ácido clorhídrico (HCl).
Veamos un segundo ejemplo, un poco más complicado:
Ahora, intenta hacer el siguiente ejercicio:
Añadir cloro molecular (Cl2) a la molécula 2,2,4-trimetilpentano.
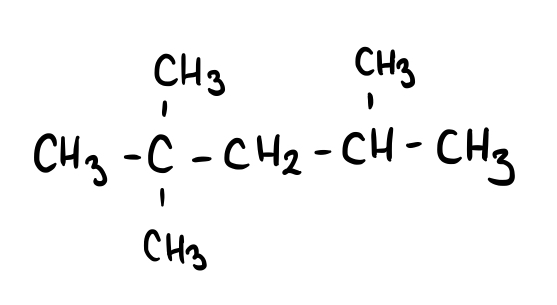
Fig. 7: 2,2,4-trimetilpentano.
Intenta identificar los productos que se formarán cuando esta molécula reaccione con cloro molecular (Cl2).
La reacción será la siguiente:
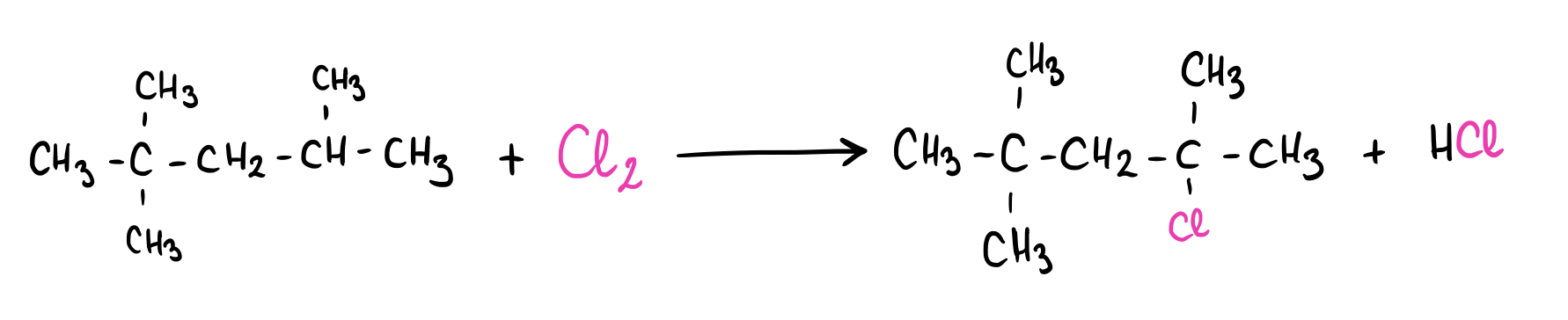
Fig. 8: Mecanismo de reacción del 2,2,4-trimetilpentano con el cloro molecular (Cl2).
Como puedes observar, los productos son 2-cloro-2,4,4-trimetilpentano y ácido clorhídrico (HCl). Por lo tanto, esta reacción es la halogenación con cloro del 2,2,4-trimetilpentano.
Halogenación de alquenos
A continuación veremos un ejemplo de la halogenación de alquenos:
¿Qué productos se producen cuando el eteno reacciona con bromo molecular?
En primer lugar, veamos cuáles son las fórmulas de los compuestos:
$$CH_{2}=CH_{2}$$
Por lo tanto, la reacción será la siguiente:
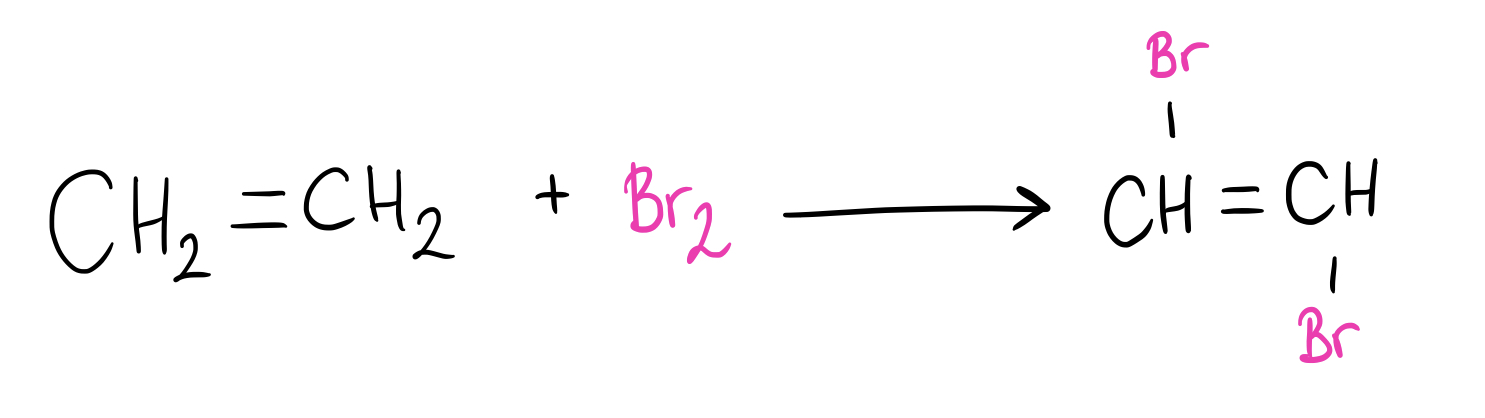
Fig. 9: Cuando el eteno reacciona con el bromo molecular, se forma el 1,2-dibromoeteno.
Como productos, se forman el 1,2-dibromoeteno; además, se libera hidrógeno molecular (H2).
Halogenación del benceno
Ahora es el turno de las reacciones de halogenación con benceno. Vamos a ver un ejemplo:
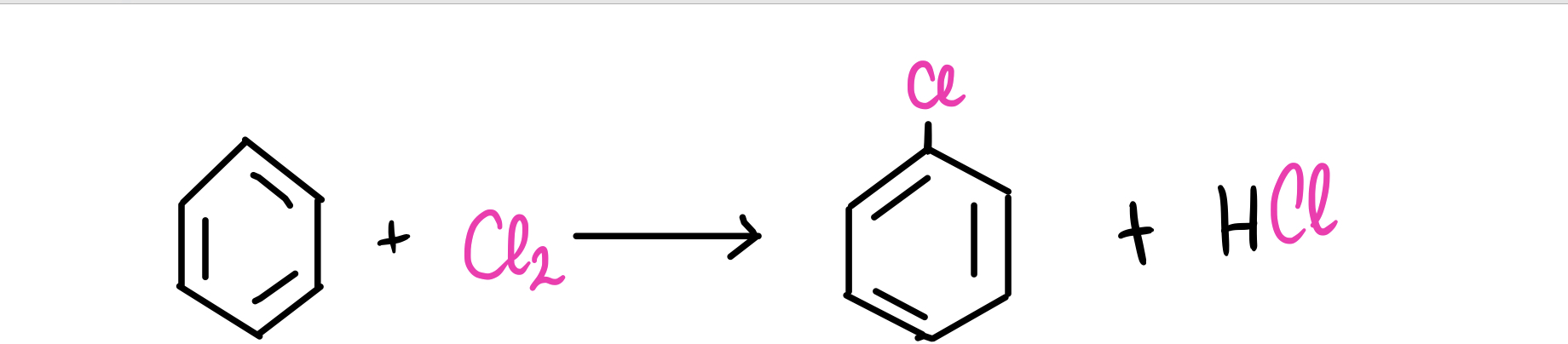
Fig. 10: reacción del benceno con cloro molecular (Cl). Los productos son el clorobenceno y el ácido clorhídrico.
Cuando el benceno reacciona con un halógeno, en este caso el cloro molecular (Cl2), se forma una molécula de clorobenceno y ácido clorhídrico (HCl).
Reacciones de compuestos halogenados - Puntos clave
- Los halógenos son los elementos químicos que se encuentran en el grupo VIIde la tabla periódica:
- El flúor (F) es el primero de los halógenos. Su número atómico es 9.
- El cloro (Cl) es el segundo de los elementos químicos halógenos. Su número atómico es 17.
- El bromo (Br) es el tercer halógeno de la tabla periódica. Su número atómico es 35.
- El yodo (I) es el cuarto halógeno de la tabla periódica y su número atómico es 53.
- El astato (At) es el quinto y último halógeno de la tabla periódica. Su número atómico es 85.
- Sus principales características son las siguientes:
- Son elementos diatómicos, ya que solamente les falta un electrón para llenar su capa de valencia (regla del octeto) por lo que cada átomo se junta con otro de su misma especie para ser más estables.
- Son muy reactivos.
- Son muy electronegativos.
- Son elementos químicos bastante peligrosos para el ser humano.
- Se pueden encontrar en estado gaseoso (cloro y flúor), líquido (bromo) o sólido (yodo y astato).
- Generalmente, forman sales cuando se unen con otros elementos.
- La halogenación es un tipo de reacción química en la que a una molécula se le añaden uno o varios átomos de halógeno; es decir, de flúor, cloro, bromo, yodo o astato.